La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a lo que la teoría de la evolución en biología (que sucedió al concepto de la Gran Cadena del Ser) y las leyes de la termodinámica en la física clásica».
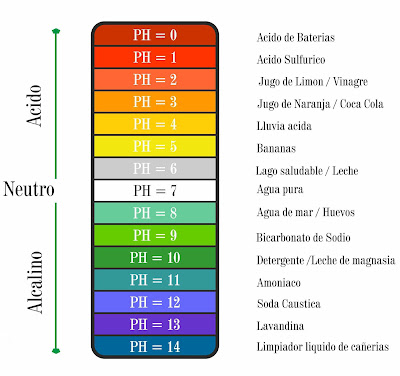
![{\mbox{pH}}=-\log _{{10}}\left[{\mbox{a}}_{{H^{+}}}\right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/04c5c5a7ad592410ab02d87dff3b00c1c636982e)